Авторы: Hideyuki Shiomi, Arata Sakai, Ryota Nakano, Shogo Ota, Takashi Kobayashi, Atsuhiro Masuda, Hiroko Iijima
Содержание:
- ВВЕДЕНИЕ
- СИНДРОМ ПРИВОДЯЩЕЙ ПЕТЛИ
- Показания к ЭУЗИ-ГЭС у пациентов с СПП
- Техника ЭУЗИ-ГЭС при СПП
- Клинические результаты ЭУЗИ-ГЭС у пациентов с СПП
- Сравнение с другими менее инвазивными паллиативными методами лечения
- ВЫВОДЫ
ВВЕДЕНИЕ
Синдром приводящей петли (СПП) является поздним осложнением процедур Бильрот II и других гастроеюноанастомозов и определяется как механическая обструкция приводящих петель.
Он может быть классифицирован как доброкачественный или злокачественный в зависимости от причины непроходимости. Заболеваемость доброкачественным СПП, по-видимому, снизилась с достижениями в хирургии, тогда как заболеваемость злокачественным увеличилась, несмотря на достижения в химиотерапии. Могут возникнуть холангит, панкреатит и перфорация из-за повышенного внутрипросветного давления, приводящие к быстро прогрессирующему и тяжелому заболеванию, требующему немедленного лечения. Широко применяется хирургическое лечение; тем не менее, оно кажется нежелательным для пациентов с запущенными онкологическими заболеваниями, поскольку может вызвать дальнейшую заболеваемость и смертность из-за задержки или прерывания онкологического лечения.
Таким образом, пациенты с плохим состоянием и ограниченным прогнозом, как правило, предпочитают менее инвазивные методы лечения. В недавних исследованиях сообщалось об эффективности эндоскопического энтерального саморасширяющегося металлического стента (SEMS) в качестве альтернативы хирургическому лечению. Однако потенциальные ограничения включают относительно высокую частоту повторных вмешательств и сложное размещение SEMS в случаях длинных стриктур или угловатых афферентных петель.
В последнее время были разработаны различные методы терапевтического эндоскопического ультразвука (ЭУЗИ), которые внесли значительный вклад в лечение панкреатобилиарных заболеваний. Гастроэнтеростомия под контролем ЭУЗИ (ЭУЗИ-ГЭС), терапевтическая модальность ЭУЗИ, привлекла внимание как минимально инвазивный метод лечения выходной обструкции желудка. Это инновационная техника шунтирования, которая включает в себя развертывание металлического стента без прохождения через стриктуру кишечника с использованием металлического стента, совпадающего с просветом (LAMS), что еще больше повысило эффективность и безопасность. Однако данные о ЭУЗИ-ГЭС при СПП остаются ограниченными. В этой обзорной статье мы представляем обзор ЭУЗИ-ГЭС для лечения СПП, особенно злокачественного.
СИНДРОМ ПРИВОДЯЩЕЙ ПЕТЛИ
Приводящая петля представляет собой сегмент тонкой кишки, расположенный проксимальнее места гастроеюноанастомоза или еюноеюноанастомоза после гастрэктомии с реконструкцией по Бильрот II или Roux-en-Y и операцией Уиппла; он состоит из дистального отдела двенадцатиперстной кишки или проксимального отдела тощей кишки, также известного как афферентная петля.
СПП определяется как механическая обструкция афферентной петли. Этиология механической непроходимости следующая:
- послеоперационные спайки, внутренние грыжи, заворот и инвагинация,
- стеноз из-за изъязвления в месте гастроеюноанастомоза
- радиационный энтерит приводящей петли
- местно-регионарный рецидив рака
- энтеролиты, безоары и инородные тела, попавшие в афферентную петлю
Симптомы СПП связаны с повышением внутрипросветного давления из-за накопления желчных, панкреатических и энтеральных секретов в замкнутом контуре после частичной и полной обструкции афферентных петлей. Основными симптомами являются вздутие живота, боль в верхней части живота, тошнота и рвота из-за дилатации. Кроме того, нарушается отток панкреатического сока и желчи, что приводит к развитию панкреатита и восходящего холангита.
Сообщалось, что пациенты, перенесшие операцию Уиппла, более восприимчивы к панкреатобилиарным симптомам из-за потери папиллярной функции. В тяжелых случаях вздутие кишечника и ишемия могут привести к некрозу кишечника, перфорации и перитониту, что в последующем приводит к развитию сепсиса из-за транслокации разросшихся бактерий в системный кровоток. Поэтому необходима ранняя диагностика и лечение до того, как заболевание станет тяжелым.
Частота развития СПП после дистальной гастрэктомии с реконструкцией по Бильрот II или Roux-en-Y колеблется от 0,2% до 1,0%.
Лечение синдрома афферентной петли:
- Чрескожный дренаж
- Прямой чрескожный дренаж
- Чрескожный чреспеченочный желчный дренаж
- Эндоскопический дренаж
- Эндоскопическая баллонная дилатация
- Эндоскопическая энтеральная установка пластикового стента
- Эндоскопическая энтеральная установка металлического стента
- Эндоскопический дренаж под ультразвуковым контролем
- Эндоскопическая гастроэнтеростомия под ультразвуковым контролем
- Эндоскопический билиарный дренаж под ультразвуковым контролем
Лечение СПП зависит от того, является ли причина обструкции доброкачественной или злокачественной. Если доброкачественные поражения вызывают СПП, хирургическое вмешательство выбирается в качестве первого выбора для радикального лечения.
Если злокачественные новообразования вызывают СПП, в качестве паллиативного подхода выбирают дренирование, поскольку радикальное хирургическое лечение невозможно, а состояние больного часто неудовлетворительное. Чрескожный чреспеченочный/транслюминальный дренаж является основным методом лечения злокачественного СПП. Варианты лечения включают чрескожное чреспеченочное билиарное дренирование (ЧЧБД) и прямое чрескожное транслюминальное дренирование расширенных афферентных петель. Эти методы лечения являются минимально инвазивными и подходят для лечения злокачественного СПП. Однако к недостаткам можно отнести снижение качества жизни из-за наличия наружного свища и риск развития серьезных осложнений, таких как бактериемия на фоне восходящего холангита, гемобилия, внутрибрюшинное кровотечение, билиарный перитонит.
Недавние достижения в области эндоскопических вмешательств предоставили новые альтернативные терапевтические возможности. Эндоскопические подходы включают энтеральное размещение двойного пигтейла или металлического стента или баллонную дилатацию. В ретроспективном исследовании Pannala et al., 15 из 24 (62%) больных со злокачественным СПП после операции Уиппла по поводу рака поджелудочной железы подверглись эндоскопическому вмешательству. Среди этих пациентов у 11 (73%) были успешные клинические результаты. Тем не менее, рецидив возник у 75% пациентов, которым был установлен пластиковый стент, что потребовало ЧЧБД или чрескожного билиарного стентирования. Таким образом, при злокачественном СПП установка металического стента предпочтительнее, чем баллонная дилатация и установка пластикового стента, чтобы избежать рецидива.
Недавно стал доступен баллонный эндоскоп (БЭ) с рабочим каналом 3,2 мм, который позволяет проводить энтеральное введение SEMS (саморасправляющийся металлический стент) с использованием эндоскопического метода. Этот тип БЭ полезен для энтеральной установки SEMS, если обычный эндоскоп не может достичь места стеноза. Кроме того, в случае окклюзии SEMS может быть выполнено дополнительное размещение SEMS. Таким образом, энтеральное размещение SEMS с использованием БЭ с большим рабочим каналом является эффективным, менее инвазивным и многообещающим методом лечения злокачественного СПП и может стать первым выбором лечения. Тем не менее, эндоскопическое энтеральное размещение SEMS через стриктуру иногда затруднено из-за длинного кишечного сегмента, длинного сегмента стриктуры и острого угла наклона петли. Затем для преодоления этих ограничений необходим альтернативный подход к лечению злокачественного СПП.
Показания к ЭУЗИ-ГЭС у пациентов с СПП
ЭУЗИ-ГЭС включает создание обходного пути путем анастомозирования желудка и кишечных стенок с использованием стента под контролем УЗИ. Это может быть выгодно при лечении пациентов со злокачественным СПП, поскольку стент не проходит через энтеральную стриктуру.
Ранее выполнялась ЭУЗИ-ГЭС с размещением стента в виде косички; однако этот метод может сопровождаться осложнениями, такими как интраоперационная и послеоперационная несостоятельность. Тем не менее, недавнее появление LAMS, которые состоят из полностью закрытого металлического стента с двусторонними фиксирующими фланцами, способствовало дальнейшему развитию ЭУЗИ-ГЭС, чтобы стать более безопасной и эффективной процедурой при СПП, с потенциально высоким уровнем успеха и сниженным риском миграции стента.
ЭУЗИ-ГЭС можно выполнять, если расстояние от датчика ЭУЗИ до афферентных петель не превышает 1 см. Однако он не показан пациентам, подвергающимся эндоскопическим процедурам, при наличии коагулопатии, промежуточных сосудов и нестабильных состояний. При асците ЭУЗИ-ГЭС может быть выполнена в случаях с небольшим количеством жидкости, но ее следует избегать при массивном асците из-за плохого формирования свища, что может привести к перитониту и инфекции.
Техника ЭУЗИ-ГЭС при СПП
Для успешной ЭУЗИ-ГЭС важно точно оценить расположение желудка и афферентных петель, используя аксиальные и корональные КТ изображения в качестве ориентиров. Кроме того, во избежание осложнений следует проверить коллатеральные сосуды и асцит.
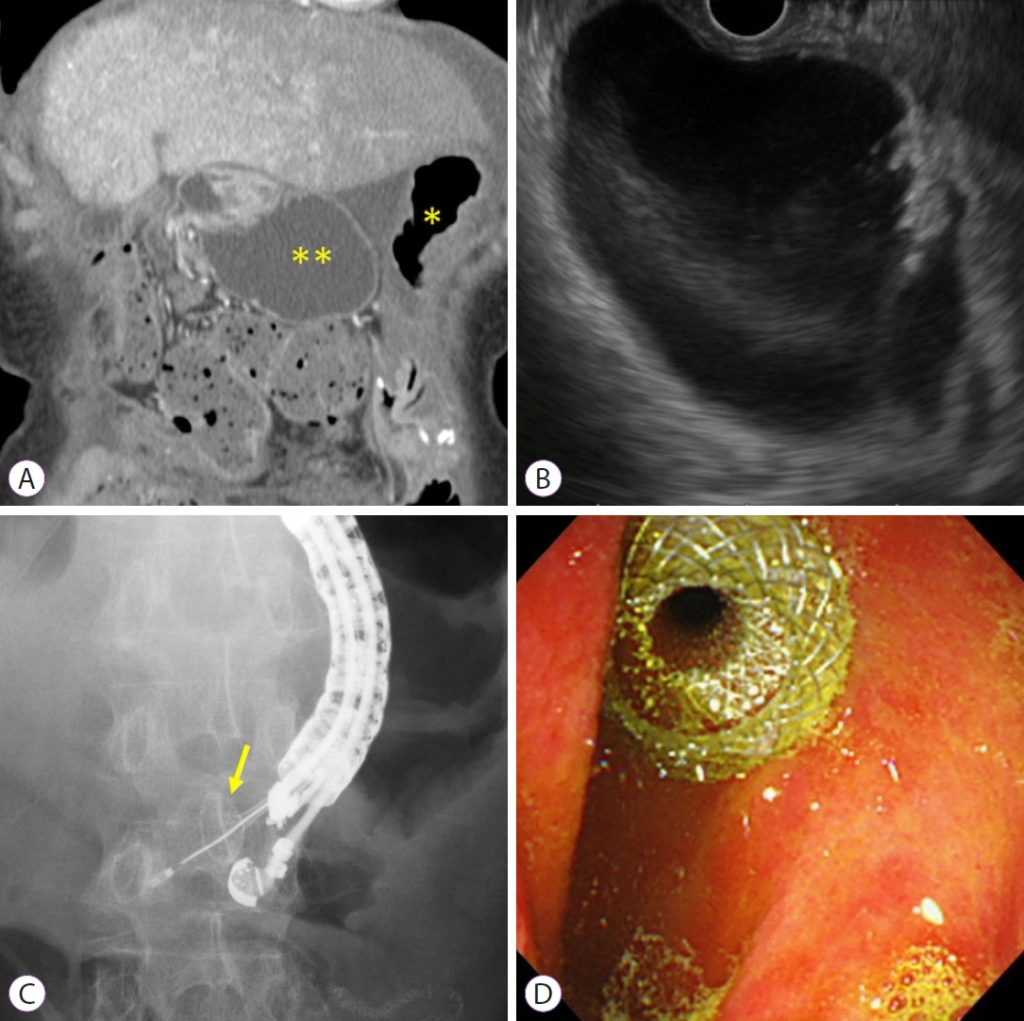
Под контролем ЭУЗИ расширенные афферентные петли идентифицируются из желудка. Если расстояние от желудка до афферентных петель оценивается более чем в 1 см, процедуру следует прекратить или переключиться на альтернативное лечение, такое как эндоскопическое энтеральное стентирование. Расширенные афферентные петли прокалывают с помощью иглы 19-G. Контрастное вещество вводят через иглу после аспирации содержимого. Затем в расширенные приводящие петли вводят жесткий проводник диаметром 0,025 или 0,035 дюйма и фистулу расширяют с помощью баллонного катетера, механических или электрокаутерных расширителей. Наконец, LAMS развертывается от расширенных афферентных петель к желудку. Этот метод широко используется как классическая многошаговая процедура. Недавно была разработана LAMS с электрокаутерным усилением (EC-LAMS), которая включает в себя присоединение к прижигающей проволоке на кончике системы доставки. Он позволяет выполнять пункцию, дилатацию и развертывание стента за один шаг, облегчая процедуру, сокращая ее время и снижая риски (рис. 1).
Рисунок 1: Эндоскопическая гастроэнтеростомия под ультразвуковым контролем. (A) Компьютерная томография с контрастным усилением показывает, что расширение афферентных петель связано с рецидивом рака поджелудочной железы (*, желудок; **, расширенные афферентные петли). (B) ЭУЗИ показывает расширение афферентных петель от желудка. (C) Расширенные афферентные петли прокалываются с помощью EC-LAMS, а дистальный конец затем развертывается под контролем ЭУЗИ (желтая стрелка: дистальный конец). (D) Проксимальный конец развернут под эндоскопическим изображением. EC-LAMS, металлический стент, примыкающий к просвету с помощью электрокоагуляции.
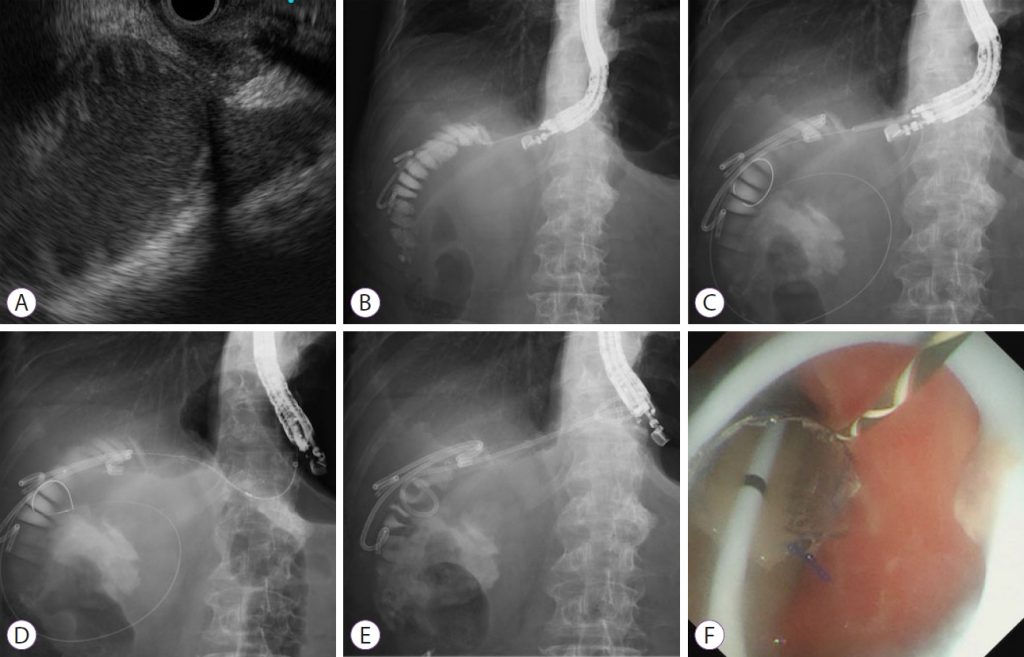
Преимущество LAMS заключается в предотвращении миграции стента и утечки жидкости. Однако они недоступны во многих странах и стоят дороже, чем обычные полностью покрытые саморасширяющиеся металлические стенты (FCSEMS). Шиоми и др. разработали модифицированную стент-систему для предотвращения миграции стента и утечки жидкости, аналогичную LAMS. Этот метод предполагает развертывание FCSEMS с функциями антимиграции; он состоит из пластикового стента с двойной косичкой с большой петлей внутри FCSEMS (рис. 2).
Рисунок 2: Эндоскопическая гастроэнтеростомия под ультразвуковым контролем с использованием полностью закрытого саморасширяющегося металлического стента в сочетании с большим петлевым стентом с двойной косичкой. (A) На эндоскопическом ультразвуковом изображении расширенные афферентные петли можно визуализировать из желудка. (B) Расширенные афферентные петли прокалываются с помощью иглы 19-G и вводится контрастное вещество. (C) Проводник вводится в афферентные петли, и фистула расширяется с помощью баллонного катетера. (D) Полностью покрытый саморасширяющийся металлический стент развертывается для соприкосновения приводящих петель и желудка. (E, F) Через полностью закрытый саморасширяющийся металлический стент вводят большой пластиковый стент с двойной косичкой.
Клинические результаты ЭУЗИ-ГЭС у пациентов с СПП
Отчеты были найдены в базе данных PubMed для англоязычных исследований с использованием следующих ключевых слов: «синдром приводящей петли» и «эндоскопическая гастроэнтеростомия под ультразвуковым контролем»/«эндоскопическая гастроэнтеростомия под ультразвуковым контролем»/«энтероэнтеростомия под эндоскопическим ультразвуковым контролем».
Мы рассмотрели клинические данные 35 пациентов, полученные из девяти тематических исследований и двух ретроспективных исследований. Общий технический и клинический успех составил 100%. Частота нежелательных явлений составила 11,4% (n=4), и все четыре пациента испытывали боль в животе (легкая, n=3, умеренная, n=1). Серьезных нежелательных явлений, таких как кровотечение, перитонит или перфорация, не наблюдалось. 32 из 35 пациентов лечились с установкой LAMS. Из них 21 подверглись одноэтапному развертыванию EC-LAMS. Эти результаты показывают, что ЭУЗИ-ГЭС может быть эффективным и безопасным методом лечения СПП. Однако возможна предвзятость публикации, поскольку количество случаев было небольшим, а процедуры выполнялись только экспертами. Поэтому необходимы дальнейшие испытания с участием большего числа пациентов.
Сравнение с другими менее инвазивными паллиативными методами лечения
Несколько предыдущих исследований сравнивали ЭУЗИ-ГЭС с другими менее инвазивными методами лечения, включая PTD и эндоскопическое энтеральное стентирование.
Брюэр и др. сообщили о результатах своего ретроспективного сравнительного исследования ЭУЗИ-ГЭС и эндоскопического энтерального стентирования у пациентов со злокачественным СПП. Они косвенно сравнили многоцентровые данные пациентов, получавших ЭУЗИ-ГЭС (n=18), с одноцентровыми данными пациентов, пролеченных эндоскопическим энтеральным стентированием (n=17). Сообщалось, что частота клинически успешных исходов была значительно выше у пациентов, перенесших ЭУЗИ-ГЭС, чем у тех, кто перенес эндоскопическое энтеральное стентирование с точки зрения полного разрешения симптомов (88,9% против 5,9%; P<0,001). Не было существенной разницы в частоте технического успеха (100% против 88,2%; P = 0,23), частоте нежелательных явлений (16,7% против 5,9%; P = 0,67) или времени процедуры (29,7 против 41,6 минут; P =0,13) между двумя группами.
Однако частота необходимости повторного вмешательства была значительно ниже в группе ЭУЗИ-ГЭС, чем в группе эндоскопического энтерального стентирования (16,7% против 76,5%; P<0,001). Эти результаты показали, что ЭУЗИ-ГЭС имеет более высокий уровень клинического успеха и более низкую частоту повторных вмешательств, чем эндоскопическое энтеральное стентирование. Поскольку ЭУЗИ-ГЭС имеет потенциальное преимущество дренирования без пересечения стриктур приводящих петель, она может дать более благоприятный исход, чем эндоскопическое энтеральное стентирование.
ВЫВОДЫ
Хотя данные остаются ограниченными, ЭУЗИ-ГЭС представляется многообещающим вариантом минимально инвазивного лечения СПП, особенно злокачественного. Кроме того, доступность EC-LAMS сделала ЭУЗИ-ГЭС более простой и безопасной процедурой.
ЭУЗИ-ГЭС можно рассматривать как терапию первой линии у пациентов с СПП, поскольку она дает лучшие клинические результаты, чем другие менее инвазивные методы лечения, такие как эндоскопическая энтеральная установка SEMS. На сегодняшний день опубликовано несколько отчетов о клинических случаях и ограниченное количество ретроспективных исследований; однако проспективные исследования не проводились. Таким образом, необходимы дальнейшие проверенные проспективные рандомизированные контролируемые исследования, чтобы установить ЭУЗИ-ГЭС в качестве стандартного лечения СПП.